企业名称:郑州永利服务医疗器械有限公司
联系人:李经理
手机: 15003718881 15003718887 15803716767
监督:15003716161
邮箱:58775877@qq.com
网址:phactfilm.com
地址:郑州高新技术产业开发区莲花街316号5幢20层88号
业在医疗器械产品注册(备案)过程中,需向食品药品监督管理部门提供产品技术要求,同时,企业在进行医疗器械产品注册检验时,也需向承检的检验机构提供产品技术要求。
可见,医疗器械产品技术要求的作用是取代之前的医疗器械产品注册标准,是医疗器械产品注册标准的简化版本。与注册标准相比,技术要求主要有以下调整:
简化注册标准内容,只保留产品型号/规格及其划分说明、性能指标、检验方法、术语以及附录5部分。
有关产品生物学评价要求的内容可不必写入产品技术要求。
产品技术要求将以附件的形式附加到医疗器械注册证上。
基于此,企业在编制医疗器械产品技术要求时应当遵循以下原则:
医疗器械产品技术要求编号
医疗器械产品技术要求编号为对应产品的注册证号(或备案号),新注册(备案)产品的技术要求编号可留空。
产品名称规范
产品技术要求中的产品名称应使用中文,并与申请注册(备案)的中文产品名称相一致。
产品型号/规格及其划分说明
产品技术要求中应明确产品型号和/或规格,以及其划分的说明。对同一注册单元中存在多种型号和/或规格的产品,应明确各型号及各规格之间的所有区别(必要时可附相应图示进行说明),对于型号/规格的表述文本较大的可以附录形式提供。
合理制订性能指标要求
产品技术要求中的性能指标是指可进行客观判定的成品的功能性、安全性指标以及质量控制相关的其他指标。产品设计开发中的评价性内容(例如生物相容性评价)原则上不在产品技术要求中制定。
产品技术要求中性能指标的制定应参考相关国家标准/行业标准并结合具体产品的设计特性、预期用途和质量控制水平且不应低于产品适用的强制性国家标准/行业标准。
产品技术要求中的性能指标应明确具体要求,不应以“见随附资料”、“按供货合同”等形式提供。
明确检验方法
检验方法的制定应与相应的性能指标相适应。应优先考虑采用公认的或已颁布的标准检验方法。检验方法的制定需保证具有可重现性和可操作性,需要时明确样品的制备方法,必要时可附相应图示进行说明,文本较大的可以附录形式提供。
对于体外诊断试剂类产品,检验方法中还应明确说明采用的参考品/标准品、样本制备方法、使用的试剂批次和数量、试验次数、计算方法。
附录形式提供附加信息
对于第三类体外诊断试剂类产品,产品技术要求中应以附录形式明确主要原材料、生产工艺及半成品要求。
其它注册事项
医疗器械产品技术要求的编制应符合国家相关法律法规及标准规范要求。
医疗器械产品技术要求中应采用规范、通用的术语。如涉及特殊的术语,需提供明确定义,并写到“4.术语”部分。
医疗器械产品技术要求中的检验方法各项内容的编号原则上应和性能指标各项内容的编号相对应。
医疗器械产品技术要求中的文字、数字、公式、单位、符号、图表等应符合标准化要求。
如医疗器械产品技术要求中的内容引用国家标准、行业标准或中国药典,应保证其有效性,并注明相应标准的编号和年号以及中国药典的版本号。
企业如何编制合格的医疗器械技术要求?
1. 编制流程
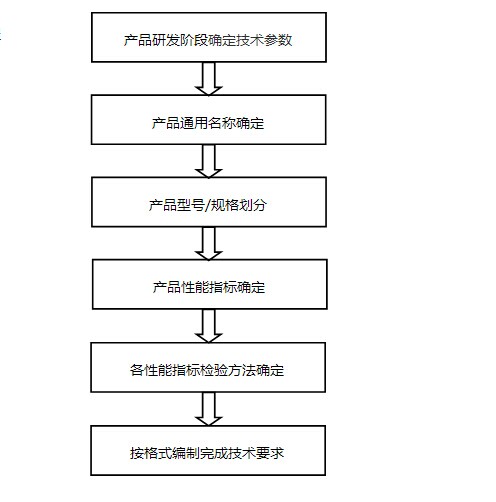
2. 编制方法
产品已发布国标或行业标准的,可参照国标或行标,结合产品特性编制;
产品已有注册标准的,可参照同品种产品注册标准或企业标准进行编制;
如产品已发布国际标准或国外已有同品种产品标准,可参照进行编制;
如产品为全新产品,企业可根据同类产品标准并结合产品自身特性进行编制;
编制过程中,所有检验方法必须符合中国相关检验标准或中国药典所载方法要求,并经过国家药监总局指定检验机构的验证。
结束语
医疗器械技术要求的编制是对所注册医疗器械产品的综合性的识别定性过程,在编制过程中既要全面了解产品个性化的特性,又要熟悉产品在医疗器械法规下应满足的技术要求, 因此编制医疗器械产品技术要求人员应同时熟悉产品技术特点、全面了解产品行业法规标准规范、精通医疗器械产品检验技术方法及具有标准编制技术基础。 企业只有在编制出符合标准规范的产品技术要求,才能确保在产品注册过程的顺利进行,同时保障产品上市后风险。